Eine aktuelle Studie der Karl Landsteiner Privatuniversität für Gesundheitswissenschaften (KL Krems) untersucht, wie Mutationen in den Proteinen α2δ-1 und α2δ-3 die Funktion des Nervensystems beeinflussen. Die Forschenden konnten zeigen, dass diese genetischen Veränderungen die Einbindung der Proteine in Zellmembranen und Synapsen reduzieren, ohne die Aktivität von Kalziumkanälen oder transsynaptische Signalwege zu verändern.
Die Studie, die im Rahmen des Forschungsschwerpunkts „Mental Health and Neuroscience“ durchgeführt wurde, verdeutlicht, dass kleine Veränderungen in der Proteinfunktion die Bildung von Synapsen und damit das Nervensystem beeinflussen können. Dies könnte neue Perspektiven für das Verständnis und die gezielte Behandlung von Autismus-Spektrum-Störungen (ASS) eröffnen.
Genetische Faktoren und neuronale Mechanismen
Autismus-Spektrum-Störungen sind komplexe neurologische Entwicklungsstörungen, die weltweit Millionen von Menschen betreffen. Ein erheblicher Anteil der Ursachen wird mit genetischen Faktoren in Verbindung gebracht. Insbesondere Mutationen in den Genen CACNA2D1 und CACNA2D3, die für die Proteine α2δ-1 und α2δ-3 kodieren, sind mit ASS assoziiert. Diese Proteine spielen eine Rolle in der Regulation von Kalziumkanälen und der Synapsenbildung, jedoch war ihr genauer Einfluss bislang unklar.
Das Forschungsteam der KL Krems untersuchte die Mutationen p.R351T in α2δ-1 und p.A275T in α2δ-3 und stellte fest, dass diese den Einbau der Proteine in Membranen der Nervenzellen verringern und ihre Lokalisierung in Synapsen beeinträchtigen. Dabei blieb die Kalziumkanalaktivität unbeeinträchtigt, was darauf hindeutet, dass strukturelle Veränderungen der Proteine eine grössere Rolle spielen als bisher angenommen.
Neue Perspektiven für die Forschung
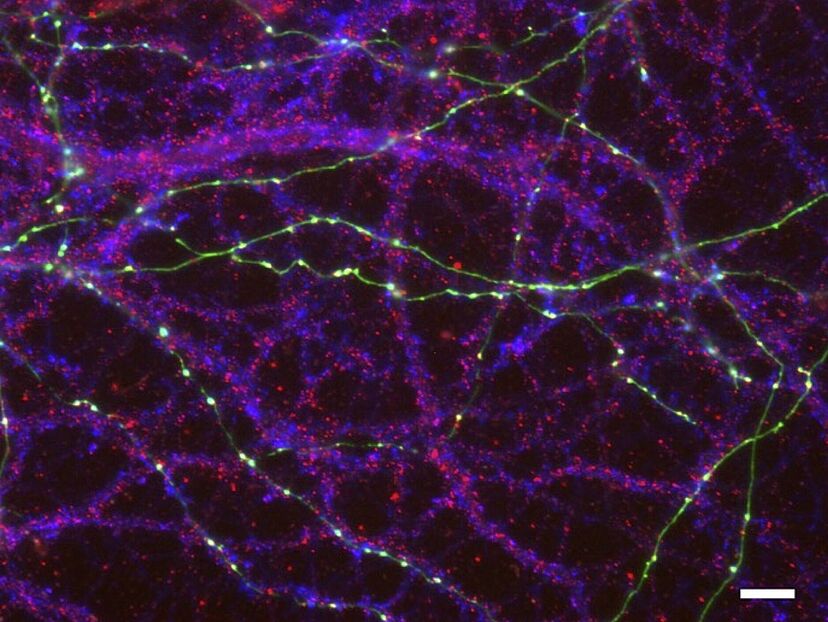
Neben Nervenzellkulturen aus dem Hippocampus kamen in der Studie moderne elektrophysiologische Methoden zum Einsatz. Die Forschenden beobachteten eine signifikant reduzierte Expression der α2δ-Proteine in den Zellmembranen, insbesondere in Dendriten und Axonen – den zentralen Strukturen für die neuronale Vernetzung.
Zudem zeigte sich, dass die p.A275T-Mutation des α2δ-3-Proteins dessen Glykosylierung verändert. Dieser Prozess ist essenziell für die Stabilität und Funktion von Proteinen. Trotz dieser strukturellen Veränderung blieben die Kalziumkanalaktivität und die synaptische Signalübertragung unbeeinträchtigt, was darauf hinweist, dass die Mutationen die Struktur der Synapsen beeinflussen, jedoch nicht direkt deren Funktion stören.
Bedeutung für zukünftige Forschung und Therapieansätze
Die Ergebnisse legen nahe, dass Mutationen in α2δ-Proteinen nicht durch eine Fehlfunktion der Kalziumkanäle wirken, sondern durch eine fehlerhafte Proteinlokalisierung in neuronalen Netzwerken. Dies eröffnet neue Perspektiven für die Forschung und könnte langfristig zur Entwicklung innovativer Diagnose- und Therapiemethoden für Autismus-Spektrum-Störungen beitragen.
„Unsere Arbeit zeigt, dass subtile Veränderungen in Proteinen tiefgreifende Auswirkungen auf die neuronale Entwicklung haben können. Um die genauen Zusammenhänge weiter zu verstehen, sind jedoch noch intensive Untersuchungen notwendig“, erklärt Prof. Dr. Gerald Obermair, Leiter des Fachbereichs Physiologie an der KL Krems.
Die Forschung liefert einen weiteren Baustein zum Verständnis der genetischen Grundlagen von ASS und bietet neue Ansatzpunkte für zukünftige therapeutische Strategien.
Literatur
Autism-Linked Mutations in α2δ-1 and α2δ-3 Reduce Protein Membrane Expression but Affect Neither Calcium Channels nor Trans-Synaptic Signaling. S. Haddad, M. Campiglio, M. Hessenberger, C. Ablinger, C. Eibl & G. J. Obermair. pharmaceuticals 2024, 17, 1608. DOI: 10.3390/ph17121608.